蛋白质结构预测技术的突破性进展,为疫苗研发提供了前所未有的洞察力。作为连接蛋白质序列与功能的桥梁,精确的结构预测能够从分子层面揭示抗原与抗体的相互作用机制,指导疫苗的精准优化。
在疫苗研发流程中,结构预测技术已成为不可或缺的关键环节:在早期筛选阶段,通过预测候选抗原的结构稳定性,显著提高筛选效率;在优化阶段,基于结构信息进行定点改造,增强抗原的免疫原性;在评估阶段,通过模拟抗原与免疫受体的结合模式,预测疫苗的潜在效果。
AlphaFold3 结构预测技术的突破,为蛋白质结构解析带来革命性进展。我们将其应用于疫苗研发,可快速精准预测抗原蛋白的三维结构,以及抗原与免疫细胞受体、抗体等分子的相互作用模式。
通过分析这些结构信息,能明确抗原的关键表位和结合位点,为疫苗设计与优化提供精准指引。例如在某病毒疫苗研发中,借助该技术成功定位病毒抗原与宿主细胞受体的结合界面,据此设计的针对性突变,有效阻断了病毒入侵,显著提升了疫苗的抗病毒效果。
作为强大工具,AlphaFold3 助力我们深入理解蛋白质结构与功能的关联,为高效疫苗研发提供坚实支撑。
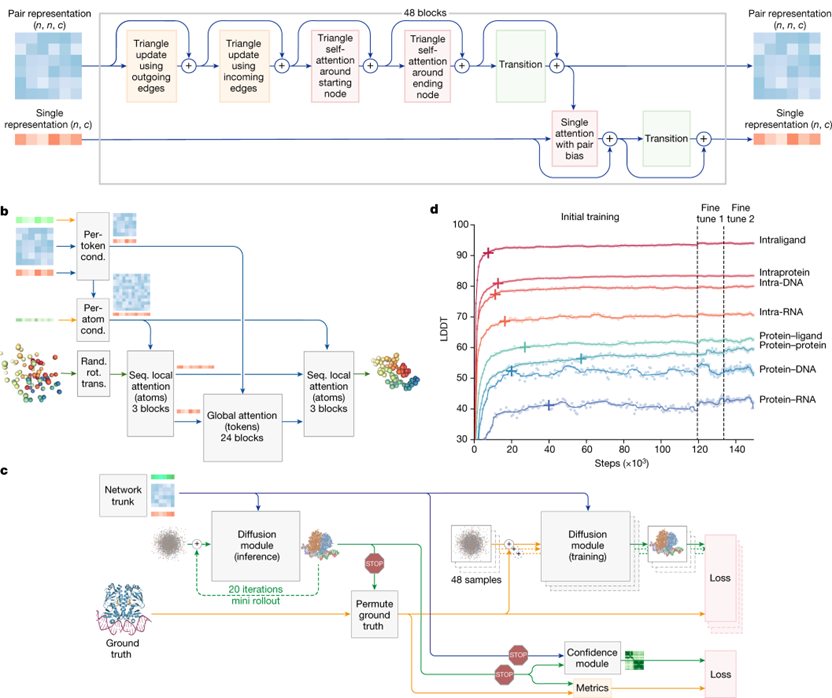
图:AlphaFold3架构和训练原理
蛋白质分子设计技术正引领着生物医药领域的革命性突破,其中理性设计与从头设计构成了蛋白质工程的两大核心技术路径。
理性设计基于对蛋白质结构和功能的深入理解,通过定点突变、结构域重组等手段对天然蛋白质进行改造与优化。我们的理性设计平台整合了高精度结构解析数据和分子动力学模拟技术,能够精准预测单点或多点突变对蛋白质稳定性、结合特异性及生物活性的影响。在疫苗开发中,这一技术被广泛应用于抗原热稳定性提升、免疫原性增强等关键环节,显著改善了疫苗的储存条件和免疫效果。
从头设计则打破了对天然蛋白质序列的依赖,通过计算机算法从头构建具有特定结构和功能的全新蛋白质。我们开发的从头设计系统采用先进的能量函数和进化算法,能够在巨大的序列空间中搜索出符合预设结构和功能目标的最优序列。这种方法为创造自然界中不存在的新型疫苗候选分子提供了可能,尤其在应对新兴病原体时展现出独特优势。
通过理性设计与从头设计的有机结合,我们正不断拓展蛋白质分子的功能边界,为开发更安全、更有效的疫苗产品奠定坚实基础。
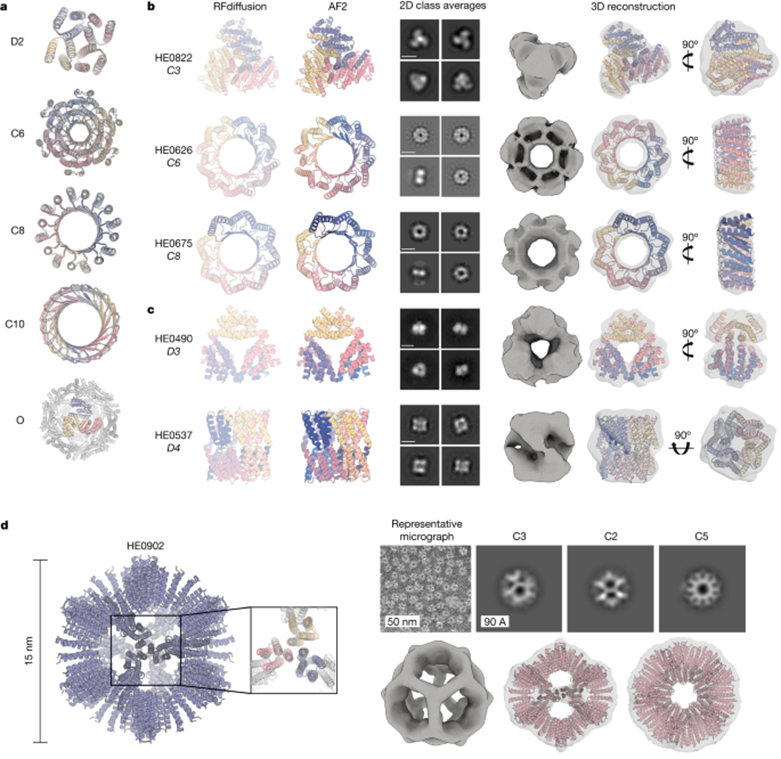
图:对称低聚物的设计与实验表征
参考文献:
Q1:目前有哪些蛋白质结构预测工具?
常用的蛋白质结构预测软件有:Alphafold3,ESMFold,RoseTTAFold。Alphafold3软件是目前准确性最高的蛋白质结构预测软件,预测结果常接近实验水平。
Q2:理性设计与从头设计在蛋白质工程中有何不同?
理性设计:基于对蛋白质结构和功能的深入理解,通过氨基酸突变、插入或缺失、结构域替换或重组等手段对天然蛋白质进行改造与优化,依赖已有的天然蛋白质结构和特性。
从头设计:打破对天然蛋白质序列的依赖,通过计算机算法(如RFdiffusion)从头构建具有特定结构和功能的全新蛋白质,能创造出自然界中不存在的蛋白质序列。